氷がとけるのは、「熱によって水の分子が動き出すから」です。
ふだん何気なく目にしている「氷がとける」現象。
でも、なぜ手で触れるだけで氷がとけていくのか、不思議に思ったことはありませんか?
実はそこには、“目に見えない世界”で起きている、小さな分子たちのダンスが関係しています。
この記事では、氷がとけるしくみを、分子の動きという視点からわかりやすく解説します。
最後には、身近な材料を使ったミニ実験も紹介しますので、ぜひ試してみてくださいね!
熱いと氷がとけるのはなぜ?
結論:熱が氷に伝わり、水の分子が動き出すから!
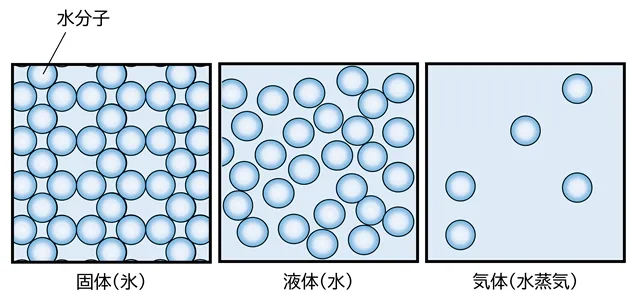
氷は、「水の分子(H2O)がギュッと固まって動かずに並んでいる状態」です。
この分子たちは、とても小さい粒のようなもので、冷たい温度ではあまり動かず、規則正しく並んでじっとしています。
でも、熱いものが近づくとどうなるのでしょう?
たとえば、手で氷を握ったとき、「あっ、冷たい!」と感じることがありますよね。
それって、実は「手の中の熱が氷にうつっている証拠」なんです。熱はいつも、温かい方から冷たい方へと流れます。
熱が氷に伝わると、そのエネルギーを受けとった水分子たちが少しずつ動き出します。
動きがどんどん活発になると、やがて「固体=氷」の形を保てなくなって、自由に動き回る「液体=水」に変わるのです。
これが、「氷がとける」という現象の正体。
熱が氷にエネルギーを与えることで、水の分子がじっとしていられなくなり、動き出してしまうわけです。

手はそんなに熱くないように感じるけど、氷がとけるのはどうして??

私たちの体温はふつう36〜37℃くらい。氷の温度は0℃以下です。
「36℃と0℃」のあいだには大きな温度差があるので、手の熱でもちゃんと氷はとけていくんですよ!

へぇ~。そもそも「氷」ってなんなんだろう?

良い質問です!次は、氷の正体を分子の世界から見てみましょう。
氷ってなに?

結論:氷は、水分子がぎゅっと並んでじっとしている“固体”の水!
私たちがふだん目にしている氷は、実は「水」が冷えて固まったものです。
でも、「固まる」とはどういうことなのでしょうか?
水は、分子(H2O)というとても小さな粒の集まりでできています。
この分子たちは、温度が高いときには元気に動き回っています。
たとえば、ぴょんぴょん飛び跳ねたり、ぶつかったり、回ったりしています。
ところが、水を冷蔵庫や冷凍庫に入れて冷やしていくと、温度が下がるにつれて分子の動きがゆっくりになっていきます。
そして0℃になるころ、水分子たちは互いに手をつなぐように並んで、動かなくなっていきます。
その状態が「氷」=水の“固体”です。
🔍 固体・液体・気体のちがいって?
ここでちょっと、身のまわりの物質の「3つのすがた」についてふれておきましょう。
| 状態 | 分子の動き方 | 例 |
|---|---|---|
| 固体 | きちんと並んで、ほとんど動かない | 氷、石、鉄など |
| 液体 | バラバラに動き回るが、まとまりがある | 水、ジュースなど |
| 気体 | 自由に飛び回って、形も大きさも決まっていない | 空気、水蒸気など |
「氷がとける」とは、固体だった水分子たちが、熱を受けてバラバラに動き出し、液体の状態になること。
この状態変化のことを「融解(ゆうかい)」と呼びます。

氷をとけさせる力をもっている「熱」って、いったいどんなものなんだろう??

鋭い質問ですね。次は、この“熱”の正体にせまってみましょう。
「熱」とはなんだろう?
結論:「熱」とは、分子を動かすエネルギーのこと!
ふだん私たちが「熱い」「冷たい」と感じるのは、実は分子の動き方の違いによるものです。
温度が高いものは、分子が元気に動き回っています。
逆に、温度が低いものでは、分子はおとなしくゆっくりと動いています。

つまり、「熱(ねつ)」とは、ものの中にある分子たちが持っている“動く力”=エネルギーのことなんです。
🔥 温度が高い=分子が元気に動いている!
たとえば、お湯の中では水の分子がバシャバシャと動きまわっています。
でも、氷の中では、水の分子はカチコチに整列して、ほとんど動いていません。

えっ、分子って見えないのに、どうしてそんなことがわかるの?

それは、科学者たちが実験や観測をくり返して、温度と分子の動きの関係を調べてきたからです。
温度が高いときは分子が速く動き、温度が低いときにはゆっくりになる。
これが、物質の基本的な性質なんです。
🧊 熱はどこからどこへ流れる?
熱は、いつも「高い温度」から「低い温度」へと流れます。
たとえば、手で氷を持つと、手の熱が氷に伝わって、氷がとけていきますよね。

じゃあ、どうして手の熱が氷に伝わるの?

それは、熱は“温かいほうから冷たいほうへ”自然に流れる性質があるからです。
つまり、手の中の分子が持つエネルギーを、氷の中の分子にバトンタッチしているようなイメージです。
このように、「熱が伝わる」とは、分子の元気さ(エネルギー)が、となりの分子にどんどん広がっていくことなのです。
では、その熱を受けとった氷の分子たちは、どう変化していくのでしょうか?
次は、氷がとけるときの分子の世界をイメージしてみましょう。
イメージしよう!分子の世界
結論:氷がとけるとは、分子が動き出してバラバラになること!

氷は、分子(H2O)がギュウギュウに整列して、ピタッとくっつきあった状態でしたね。
この状態では、分子たちはお互いに場所をゆずらず、じっと動かずに並んでいます。
そこに「熱」が伝わると、何が起こるのでしょう?
💭 小さな粒がワチャワチャ…分子たちのダンス!
最初は、分子たちは「ん?なんか温かいぞ?」と感じて、ほんの少しだけ揺れ始めます。
そして、だんだん激しくゆれたり回ったりしながら、「動きたい!」というエネルギーを持ち始めるのです。

えっ?分子が“動きたい”って思うの?

もちろん実際に“気持ち”があるわけではないですが、分子たちはエネルギーをもらうと自然に動き出す性質があるんです。
まるで踊りだすみたいにワチャワチャしはじめる様子を、イメージでとらえると覚えやすいですよ。
やがて、手をつないでいた分子たちが「もう並んでるの無理〜!」と言って、くっつくのをやめてバラバラに動き出します。
これが、「とける」=「固体から液体になる」という変化です。
🤔 「とける」って、どこまでいったら“とけた”ことになるの?

うーん、水になりかけてるのって“氷”?それとも“水”?どっち?

いい質問ですね!氷がとけはじめたときは、氷と水が混ざった状態になります。
でも、すべての分子がバラバラになって、自由に動けるようになったら、それはもう“液体=水”です。
では実際に、氷がとける様子を身近なもので観察してみたくなりませんか?
次は、ちょこっとできるミニ実験を紹介します!
ちょこっと実験してみよう
結論:氷のとけるスピードは、熱の伝わり方や周りの環境によって変わる!
ここまでで、「氷がとけるのは分子が熱を受け取って動き出すから」だと分かりましたね。
でも、氷ってどんなときに一番早くとけるのでしょうか?
それを確かめるために、かんたんな実験をしてみましょう。
特別な道具は必要なし!おうちにあるものですぐできますよ。
実験:氷を3つの条件で比べてみよう!
用意するもの
・同じ大きさの氷を3つ
・コップ 3個
・お湯(※やけどに注意)、塩(食塩)
やり方
1. 氷を3つのコップに1つずつ入れる
2. 次のように条件を変えてみる
- A:そのまま何もせず常温に置く
- B:氷に少しだけお湯をかける
- C:氷に塩をふりかける
3. それぞれの氷がどれくらいの速さでとけるかを観察してみよう!
とけるスピードを予想しよう!
「どれが一番早くとけるんだろう?」と気になったあなた。正解はこちら!
- Bのお湯をかけた氷
→ お湯は高い温度を持っているので、一気に熱が伝わり、氷はすばやくとけます。 - Cの塩をかけた氷
→ 塩には、氷の「とける温度(凝固点)」を下げる力があります。そのため、氷はとけやすくなりますが、お湯ほど熱エネルギーがないので少し時間がかかります。 - Aのそのまま置いた氷
→ 常温では、まわりの空気から少しずつ熱が伝わるだけなので、いちばんゆっくりととけていきます。
えっ?塩をかけると冷たくなるの?

塩をかけたら早くとけるのに、なんで冷たくなるの?
↑と思った人、いますよね。

これは、「凝固点降下(ぎょうこてんこうか)」という現象がかかわっています。
塩を加えることで、氷のとける温度が下がるため、氷はどんどんとけようとします。
でもそのとき、氷は“自分のまわりから熱をうばいながら”とけていくんです。
そのせいで、まわりの温度はむしろもっと下がってしまうんですね。
この実験から、「氷がとける速さは、熱の伝わり方やまわりの条件によって変わる」ということがよくわかります。
コラム:塩水はマイナス20度でも凍らないって本当?そして道路にまくのは「塩」じゃないの?

氷に塩をかけるととけやすくなるって話、ちょっと不思議ですよね。
しかも、塩水はマイナス20℃でも凍らないって聞いたら…「えっ!?」って思いませんか?
このナゾをとくカギは、「凝固点降下(ぎょうこてんこうか)」という現象です。
水はふつう0℃で凍りますが、そこに塩を混ぜると、凍る温度がどんどん下がるんです。
たとえば、限界まで塩を溶かした「飽和食塩水」だと、なんと−21℃くらいにならないと凍りません!
❄️ 雪国の道路にまくのは「塩」じゃない!?
「冬に道路にまく“あの白い粉”も塩なのかな?」と思った方もいるかもしれませんね。
実は、雪国で使われているのは塩化カルシウム(CaCl₂)という物質です。
食塩とちがって、もっと低い温度でも効果を発揮し、しかも水と反応すると発熱するので、氷を積極的にとかす力があります。
| 物質 | 凍る温度(目安) | 特徴 |
|---|---|---|
| 食塩(塩化ナトリウム) | 約 −21℃ | 家庭でも使える・実験向き |
| 塩化カルシウム | 約 −50℃以下 | 道路や雪国で使われる・発熱作用あり |
💡 実験には「食塩」でOK!
もちろん、家庭での科学実験には食塩で問題ありません。
身近にある材料でも、「氷がとける速さが変わる理由」や「凝固点降下のしくみ」をじゅうぶん体験することができます。
では最後に、ここまで学んだことをぎゅっとまとめてみましょう!
まとめ:氷がとけるのは、熱で分子が動き出すから!

氷がとける理由は、とってもシンプル。
それは、「熱」が氷に伝わって、水の分子が動き出すからです。
✔ 氷がとけるしくみをおさらい!
- 氷は、分子がきちんと並んでじっとしている「固体」の状態
- そこに熱(エネルギー)が伝わると、分子が動き出して自由になる
- 分子がバラバラに動き回れるようになると、「液体の水」に変わる
- これが「とける」という現象の正体!
✔ 熱の正体ってなに?
- 熱とは、分子を動かす力=エネルギーのこと
- 温度が高いと、分子の動きが活発になる
- 熱は、温かいところから冷たいところへと流れる性質がある
✔ 実験で分かったこと!
- お湯をかけた氷 → 一番早くとける
- 塩をかけた氷 → 凝固点が下がってとけやすくなる
- 何もしない氷 → ゆっくりとける
✔ おどろきの豆知識!
- 飽和食塩水は −21℃でも凍らない
- 雪国で使われているのは「塩化カルシウム(CaCl₂)」
- 凍結防止や除雪に使われる理由は、より低温でも効果があるから!
このように、身近な「氷がとける」現象の中には、
熱や分子の動きなど、たくさんの科学のルールがつまっているんです。

